의료기기 산업은 대표적인 규제산업 중 하나로 어느 국가에서나 까다로운 규제 적용과 복잡한 수입절차를 거치게 된다. 말레이시아 역시 현지 의료기기법(Medical Device Act 2012)에 따라 까다로운 규정과 복잡한 현지 등록 절차가 존재하는만큼 말레이시아 진출을 검토하고 있는 한국의 관련 업체들에게 이글을 통해 현지 의료기기 판매를 위한 인증절차를 이해하고 효율적으로 완료할 수 있도록 도움을 주고자 한다.
의료기기 등록 관련 규정
말레이시아에서는 Medical Device Act 2012(Act 737, Act 738)[이하 의료기기법] 의거 의료기기의 현지 시장 출시 전 현지 당국에 등록해야 한다. 의료기기 등록 신청은 현지 의료기기법에 따른 요건과 당국이 정한 방식에 의거 이뤄져야 하며 해당 법안이 발효된 2013년 7월 1일부로 모든 의료기기에 적용되고 있다.
말레이시아 의료기기 등록 및 규제 기관
말레이시아 보건부 산하 법정 기관인 의료기기청(MDA, Medical Device Authority)는 의료기기법에 따라 설립되어 운영되며 의료기기 산업 및 활동을 규제하고 법률을 집행하게 된다. 의료기기 등록 및 승인 전반을 관할하는 기관으로서 세부사항은 아래와 같다.
<말레이시아 의료기기청(MDA) 개괄 >
|
기관명 |
Medical Device Authority(MDA) |
|
상위부처 |
Ministry of Health Malaysia(말레이시아 보건부) |
|
주소 |
Level 6, Prima 9, Prima Avenue II, Block 3547, Persiaran APEC, 63000 Cyberjaya, Selangor |
|
연락처 |
+603-8230 0300 |
|
팩스 |
+603-8290 0200 |
|
이메일 |
mdb @mda.gov.my |
|
홈페이지 |
[자료: 말레이시아 의료기기청(MDA) 홈페이지]
의료기기 등록 책임기관
현지 의료기기법에 따르면 의료기기 등록 의무가 발생하는 대상은 아래와 같다.
(a) 의료기기 제조사(단, 제조사가 말레이시아 국적 기업일 경우)
(b) 허가된 제조업체의 대리인
이에따라 현지 수출을 고려하고 있는 한국의 의료기기 제조사들의 경우 첫번째 관문인 의료기기 등록을 진행하기 위해서는 반드시 현지 인증 대리기관을 통해 현지 당국에 등록을 해야한다.
의료기기의 정의
말레이시아 의료기기법 2012(법령 737호)[Medical Device Act 2012(Act 737)] 제 2호에서 정의하는 의료기기는 다음과 같다. 이는 세계 보건기구의 정의에 따른 것이다.
"의료기기"라 함은 모든 기구, 장치, 도구, 기계, 설비류, 이식재료,체외 진단시약, 소프트웨어, 재료 또는 기타 유사물질 또는 물품 제조자가 인체에 사용하는 것을 의도하여 단독 또는 조합으로 그 사용 목적이 아래의 하나 또는 그 이상의 목적으로 사용되는 것.
(a) 질병의 진단, 예방, 모니터링, 치료 또는 완화
(b) 부성에 대한 진단, 모니터링, 치료, 완화 또는 보조
(c) 해부학이나 생리학적인 검사, 대체, 보정 또는 지원
(d) 생명 유지
(e) 임신 통제(조절)
(f) 의료 기기의 살균 및 소독
(g) 의료정보를 제공하거나 인체에서 나온 검체의 체외 검사에 의한 진단
또한 약리학적, 면역학적 또는 신진대사의 수단에 의해 인체에서 주요 작용을 하지는 않으나 기능을 보조하기 위해 이러한 방법을 사용하는 기기
인체에 사용되는 모든 기구, 장치, 도구, 기계, 장비, 이식, 체외진단시약, 소프트웨어, 재료 또는 기타 유사 또는 관련 물질로 보건부장관이 공공의 안전, 위생 또는 위험을 고려하여, 의료기기라고 공시한 것
의료기기의 구분(등급체계)
말레이시아 의료당국은 의료기기법에 의거 의료기기를 인체에 미치는 취약성, 기술적 설계 및 위험성을 기준으로 4개의 클래스로 분류하고 있으며 이는 유럽 연합(EU)의 의료기기 규제 지침(MDD, Medical Device Directive)과 유사하게 구분하고 있다. A등급에는 외과용 견인기(Surgical Retractors), 설압기(Tongue Depressors), B 등급에는 피하주사바늘(Hypodermic Needle), 의료용 흡입장치(Suction Equipment), C등급에는 인공호흡기(Lung Ventilator), 정형외과용 임플란트(Orthopaedic Implants) 그리고 D등급에는 심장밸브(Heart Valves), 이식형 제세동기(Implantable Defibrillator) 등이 포함된다.
<말레이시아 내 의료기기 그룹핑 기준>
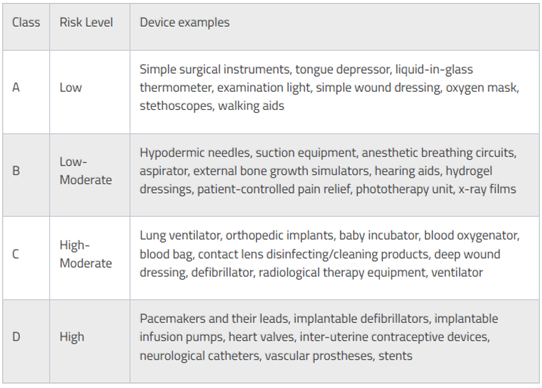
[자료 : 말레이시아 의료기기청 의료기기 지침, MEDICAL DEVICE GUIDANCE DOCUMENT]
의료기기 등록절차
< 말레이시아 의료기기 등록 절차>
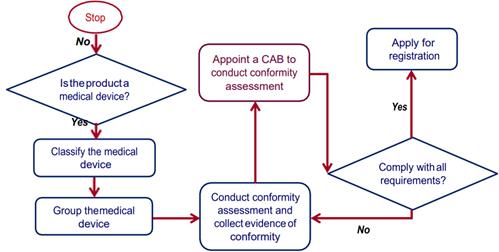
[자료: 말레이시아 의료기기청(MDA)]
현지 의료기기법에 따라 말레이시아 내 의료기기 등록절차는 아래와 같다.
(1) 신청 의료기기의 구분
우선 첫번째로 등록신청을 하고자하는 의료기기를 말레이시아 현지 의료기기법 부록 1에 따라 분류를 결정해야한다. 이는 아래의 링크를 통해 확인할 수 있다.
005 General Medical Device Grouping (mda.gov.my)
(2) 공식대리인(AR, Malaysia Authorized Representitive)의 선정
말레이시아에 등록 및 허가된 사무소가 없는 의료기기 제조업체는 말레이시아 내 공인 대리인(AR, Malaysia Authorized Representitive )을 선정해야 한다. 말레이시아의 공식 대리인은 말레이시아 의료기기청(MDA)과의 연락 담당자 역할을 하며 의료기기 등록을 제출할 책임이 있으므로 선정 단계에서 대리인을 신중하게 선택하는 것이 중요하다. 공식 대리인의 경우 말레이시아 시민권자 또는 영주권 자격을 보유하고 있는 자만이 가능하며 제조업체는 기기 제품군 당 한 명의 공식 대리인을 지정할 수 있다. 또한 대리인은 설립 허가증과 의료기기 우수 유통 관행(GDPMD, Good Distribution Practice for Medical Device)에 따른 실천지침을 이행하고 의료기기법(MDA 2012)에 의거 기관 라이선스(Establishment License, EL)의 취득이 의무화 되어 있다. 의료기기 등록은 권한 있는 대리인이 직접 제출하도록 돼 있으며, 적합성 평가 기관(CAB, Conformity Assessment Body) 인증은 대리인의 명의로 발급이 된다.
[참고] 공식 대리인 지정 이후 변경이 필요할 경우 Medical Device Guidance Document, Licensing For Establishment에 의거 신청 후 변경할 수 있다. 현 지정 대리인의 과의 계약 종료를 통보하는 내용이 포함돼 있으며 대리인 회사 책임자의 서명이 반영된 서신과 함께 의료기기 제조사의 계약종료 서신을 의료기기청(MDA)에 제출시 기존의 대리인은 자격을 상실하게 된다. 이후 새로운 대리인 임명서와 함께 제조사의 공식 서신을 통해 대리인 변경을 의료기기청(MDA)에 통보해야만 한다.
(3) 적합성 평가(CAB, Conformity Assessment Body)
의료기기 적합성 평가의 경우 말레이시아 현지에서 제조사의 제품을 판매할 수 있는지 여부를 판단하는 의료기기 안전성 및 효과성을 평가하는 것이며 이는 CAB 기관들을 통해 이뤄지게 된다. CAB 기관들의 경우 의료기기 당국에서 승인한 기관들로 구성되며 현지 의료기기법에 의거하여 의료기기 적합성 평가를 수행한다. 평가 과정에는 심사 대상 의료기기의 기술 문서 검토, 제조업체의 품질 시스템 검토, 제조 공장 검토 그리고 임상시험 결과 검토 등이 포함된다. 평가 신청시 ISO 인증서, CE 인증서 등이 있을 경우 공통 제출서류 템플릿(CSDT) 형식에 맞춰 관련 증빙서류들을 함께 제출하는 것도 가능하다. 또한 의료기기 구분 클래스 결과 A 클래스에 해당될 경우 관련 법령에 따라 적합성 평가 대상에서 면제될 수 있다. 통상 적합성 평가기관은 말레이시아 현지의 지정대리인(AR)이 선정하거나 각각의 적합성 평가기관마다 평가가 가능한 기술 분야가 다르기 때문에 적합성 평가기관의 선정에도 이를 참고할 필요가 있다.
< 의료기기 당국 선정 CAB 기관 현황 >
|
Registration Number |
Name of CAB |
|
MDA/CAB-001 |
Tüv Süd (Malaysia) Sdn. Bhd. |
|
MDA/CAB-002 |
Medcert Malaysia Sdn. Bhd. |
|
MDA/CAB-003 |
SGS Malaysia Sdn. Bhd. |
|
MDA/CAB-004 |
Sirim Qas International Sdn. Bhd. |
|
MDA/CAB-005 |
BSI Services Malaysia Sdn. Bhd |
|
MDA/CAB-006 |
DQS Certification (M) Sdn. Bhd. |
|
MDA/CAB-007 |
Tüv Rheinland Malaysia Sdn. Bhd. |
|
MDA/CAB-008 |
Tüv Nord (Malaysia) Sdn. Bhd. |
|
MDA/CAB-009 |
Care Certification International (M) Sdn. Bhd. |
|
MDA/CAB-012 |
CI International Certification Sdn. Bhd. |
|
MDA/CAB-013 |
KGS Certification Sdn. Bhd. |
|
MDA/CAB-014 |
DNV GL International Sdn. Bhd. |
|
MDA/CAB-015 |
Platinum Shauffmantz Veritas Sdn. Bhd. |
|
MDA/CAB-016 |
Genuine Diamond Sdn. Bhd. |
|
MDA/CAB-017 |
ITC Zenith (M) Sdn. Bhd. |
|
MDA/CAB-018 |
Newera International Certification Sdn. Bhd. |
|
MDA/CAB-019 |
ASI Certification Sdn. Bhd. |
|
MDA/CAB-020 |
Medivice Certification Sdn. Bhd. |
|
MDA/CAB-021 |
Kiwa International Certifications (M) Sdn. Bhd. |
|
MDA/CAB-022 |
AQC Technical Assessors (M) Sdn Bhd |
|
MDA/CAB-023 |
Niosh Certification Sdn. Bhd |
[자료: 말레이시아 의료기기청(MDA) 홈페이지]
상기 등록돼 있는 CAB 기관들에 대한 세부 정보들의 경우 다음의 의료기기청 홈페이지 링크를 통해 확인이 가능하다.
https://mda.gov.my/industry/conformity-assessment-body-cab/status.html
의료 및 IVD 장치 분야 국제 컨설팅 기업인 Aarazy Group에 따르면 의료기기 및 IVD 기계에 대한 제품군별 등록에 소요되는 기간은 A 클래스 영업일 기준 45일, B 클래스 영업일 기준 100일, C 클래스 영업일 기준 180일, D 클래스 영업일 기준 220일 정도 소요된다고 밝히고 있다. 해당 기간에 CAD 검토 기간은 포함되지 않으므로 주의할 필요가 있다. 또한 현지 의료기기법은 관련 법령에 따라 모든 적합성 평가(CAB) 신청 건당 1,500 링깃의 신청수수료와 관련 심사 최종 승인 후 등록시 8,000 링의 등록 수수료가 부과 된다. 관련 당국은 현금 결제를 허용하고 있지 않으니 참고할 필요가 있다.
(4) 온라인 의료기기 등록신청
CAD 심사로 현지 승인을 받은 후 의료기기 등록 신청은 MeDC@St 시스템을 통해 진행할 수 있다. 이는 인터넷을 통해 엑세스할 수 있는 웹 기반 온라인 신청서이며 신청자는 MeDC@St 계정을 우선 생성 해야한다. 계정이 생성되면 신청자는 시스템에 로그인하여 신청서를 작성할 수 있다. 신청양식은 아래의 세부 내용들을 포함한다.
https://medcast.mda.gov.my/admin/user/login
(a) 일반정보
(b) 제조업체 정보
(c) 의료기기 구분
(d) 공통제출 서류 템플릿 (CSDT, Common Submission Dossier Template)
(e) CSDT 관련 보완증빙 서류
(f) 시판 후 부작용 사례(임상시험 관련 자료 포함)
(g) 적합성 평가 결과(CAB, Conformity Assessment Body)
(h) 의료기기 등록신청을 위한 증명서
신청자는 상기에 요구되는 모든 서류와 정보사항을 작성하여 관련 증빙 서류들을 홈페이지내 업로드 하여야한다. 신청 접수가 완료되면 현지 의료기기청에서는 의료기기 분류 기준을 확인 후 신청서류 등에 미비사항이 발견되면 추가 서류 제출을 요청할 수 있으며, 서류 추가 제출로 미비사항이 보완될 수 없다고 판단될 경우 의료기기 등록이 최종 거부 될 수도 있다. 또한 신청 및 최종 등록 단계에서 비용이 수반되며 등급별로 아래와 같다.
<의료기기 등록신청 기기등급별 소요 비용>
(단위: 링깃(RM))
|
등급 |
신청비용 |
등록비용 |
|
Class A |
100 |
- |
|
Class B |
250 |
1,000 |
|
Class C |
500 |
2,000 |
|
Class D |
750 |
3,000 |
|
의약품 포함 의료기기 |
- |
5,000 |
[자료: 말레이시아 의료기기청(MDA)]
방사선 기기 제품등록의 경우 원자력 라이선스 법(Atomic Energy Licensing Act 1984 : AEL)에 의거하여 선 기기를 유통하고자 하는 회사는 원자력 에너지 허가위원회(Atomic Energy Licensing Board, AELB)로 부터 C 라이선스를 받아야 한다. 또한 방사선 기기를 말레이시아에 수입하기 위해서는 AELB 클래스 E 라이선스가 필요하다. 방사선 기기의 경우 원자력 에너지 허가위원회에 MDA등록과는 별도로 제품등록을 하여야 한다. E 라이선스의 경우 인터넷상의 ePermit으로 신청하고 실제 수입 전 취득해야만 한다.
(5) 의료기기 등록 승인
의료기기청의 최종 등록이 승인되면 인증서가 발급이되며 등록번호가 부여된다. 의료기기 등록 및 인증의 유효기간은 5년이며 5년마다 갱신을 해야한다. 마지막으로 의료기기 제조업체에서 지정한 공식 대리인(AR)은 현지의 수입 및 유통업체가 현지 판매를 할 수 있도록 승인서를 발급해줘야한다.
기타정보 : 라벨링
의료기기 제품들의 모든 라벨링 정보는 의료기기와 함께 제공돼야한다. 의료 시설과 같이 특정 고에게 여러 개의 의료기기를 상자에 넣어 제공을 해야하는 경우 라벨은 포장 상자에 부착하여 제공할 수 있다. 그러나 약국이나 개별환자 또는 고객에 판매 또는 제공이 될 경우 개별 의료기기마다 라벨이 부착돼야 한다. 기기 등록번호 및 현지 공인 대리인(AR) 주소 정보는 외부상자 및 외부상자 포장시에 기재돼 있어야 하며, 제조업체와 대리인은 제품 사용설명서 상 포함여부는 선택할 수 있다.
시사점
말레이시아 의료기기 시장은 앞으로도 꾸준히 성장할 것으로 기대 된다. 유로모니터에 따르면 2027년까지 말레이시아 의료기기 시장 규모는 약 27억 2천만 달러에 이를 것으로 전망하고 있다. 말레이시아 의료기기 시장의 성장은 해외의 의료기기 제조업체에게 새로운 기회를 제공할 것으로 보인다. 말레이시아 의료기기 시장에 성공적으로 진출하기 위해서는 복잡한 현지 인증절차에 대한 철저한 숙지와 더불어 의료기기의 안성과 효능을 보장하여 현지 소비자들의 니즈에 부합하는 것이 무엇보다 중요할 것이다.
[자료원 : 말레이시아 보건부(MOH), 말레이시아 의료기기청(MDA), 세계보건기구(WHO), 말레이시아 보건의료체계 조사-분석 보고서(메가젠말레이시아) 및 KOTRA 쿠알라룸푸르 무역관 자료 종합]

| 원문링크 | https://dream.kotra.or.kr/kotranews/cms/news/actionKotraBoardDetail.do?MENU_ID=70&pNttSn=202966 |
|---|
